Pour apporter de la couleur à une pièce céramique, on peut utiliser des oxydes métalliques, des colorants composés, des engobes, ajouter des métaux précieux ou encore faire un lustre. Le décor sur céramique est un vaste sujet !
-> En guise d’introduction, vous pouvez lire cet article sur l’exposition L’expérience de la couleur (2018) à la Manufacture de Sèvres. Sur le rôle de la couleur, les enjeux historiques, le sens qu’on leur donne … très intéressant !
>> Vous pourrez tester vos connaissances avec ce QUIZZ Google Form <<
(le lien est aussi en fin d’article)
Cet article concerne les savoir-faire suivants :
On peut trouver dans les annales de nombreuses questions concernant la matière d’œuvre :
– Reconnaître le décor d’œuvres céramiques (histoire de l’art)
– Quels sont les principaux constituants d’une pâte à faïence rouge ? Pourquoi cette pâte est-elle rouge ? (q.3-4, EP1A 2002)
– Donner la définition d’un engobe. Indiquer à quel moment on le pose sur les pièces et quel est son rôle. (q. 5-6, EP1A 2002)
– Quels oxydes devra-t-on utiliser pour obtenir les couleurs suivantes : bleu, vert, jaune. (q. 7, EP1A 2002)
– Quels oxydes devra-t-on utiliser pour obtenir la couleur rouge pour les 3 types de production (faïence, grès, porcelaine) ? Quel type de cuisson devrez-vous mener pour obtenir cette couleur (sous-entendu : oxydation ou réduction) ? (q.6-7, EP1A 2003)
– On vous demande un filet réalisé à l’or. Citez le type de décor approprié à ce genre de réalisation. Sur quel support se pratique-t-il ? (q.11-12, EP1A 2003)
~ Rappels chimiques ~
Pour bien comprendre la suite, il est nécessaire d’avoir quelques notions en chimie… Ma formation d’ingénieur me permettant d’avoir bien compris la plupart de ces notions, je vais les expliquer le plus simplement possible ! N’hésitez pas à me contacter si vous avez des questions (sur la chimie ou autre chose, d’ailleurs !) : contact.calliceram@gmail.com
Vocabulaire
– Un oxyde est un composé chimique résultant de la composition d’atomes d’oxygène avec un élément moins électronégatif que lui (c’est-à-dire qui attire moins à lui le doublet d’électrons d’une liaison covalente : dans le cas de l’oxygène, tous les éléments sauf le fluor et lui-même). Par extension, le terme « oxyde » désigne aussi l’ion oxyde O²-.
– La lixiviation correspond au largage d’éléments par solubilisation, en présence d’un solvant. Dans le cas de MCDA (Matériaux destinés à entrer en contact avec des denrées alimentaires), le solvant est souvent acide (café : acide phénolique, lait : acide lactique, vinaigre : acide acétique ou éthanoïque, jus de fruits : acide citrique par ex, légumes acides : acide oxalique par ex, dans la rhubarbe ou les épinards).
Réaction d’oxydo-réduction
Une réaction redox (i.e. d’oxydoréduction) correspond au transfert d’un ou plusieurs électrons entre l’oxydant d’un couple et le réducteur d’un autre couple.
En effet, on peut former des couples redox (notés Ox/Red), où l’oxydant (qui capte les électrons) et le réducteur (qui les libère) sont liés par la demi-équation : Ox + n.e- = Red. Cela signifie que l’oxydant, associé à n électrons (où n est un entier naturel (1,2,3…)), donne le réducteur (ou, dans l’autre sens, que le réducteur donne n électrons et l’oxydant). On dit que l’oxydant est réduit et que le réducteur est oxydé.
Prenons donc 2 couples redox : Ox₁/Red₁ et Ox₂/Red₂. On a donc les 2 demi-équations suivantes (demi car il faut en combiner deux pour obtenir l’équation finale) :
Ox₁ + n₁.e- = Red₁ et Red₂ = Ox₂ + n₂.e- .
Pour pouvoir les additionner, il faut qu’on puisse compenser les électrons e-, donc qu’il y en ait le même nombre dans chaque demi-équation. Pour cela, on va multiplier la 1ère équation par n₂ et la 2ème par n₁, et on additionne. C’est l’équation de la réaction redox :
n₂.Ox₁ + n₁.Red₂ = n₂.Red₁ + n₁.Ox₂ .
Le degré d’oxydation
La couleur obtenue va dépendre du degré d’oxydation dans lequel est l’élément qu’on utilise. Ce nombre est noté en chiffres romains. Son calcul est relativement simple, mais il nécessite de connaître quelques règles. J’en citerai trois :
– La somme des degrés d’oxydation des atomes d’une molécule neutre est nulle (d’où le =0)
– Dans le cas d’ions monoatomiques, le degré d’oxydation d’un ion est égal à sa charge (c’est pour cela que le degré d’oxydation x est égal au nombre dans le nom de l’oxyde. En effet, « oxyde de fer II » signifie que l’ion qui entre dans sa composition est Fe²⁺, donc le degré d’oxydation du fer doit être égal à sa charge, soit 2 (II)).
– En général, le degré d’oxydation de l’oxygène est -II.

Il est donc essentiel d’avoir conscience que parler d’ »oxyde de fer » ou d’ »oxyde de chrome » n’est pas précis du tout, car chaque élément peut former plusieurs ions différents ! Pour être tout à faire précis, il faudrait dire « oxyde de [élément] [nombre]« . C’est justement grâce à cette variété des types d’oxydes qu’on peut obtenir différentes couleurs.
Atmosphères de cuisson
° L’obtention de certaines couleurs nécessite de contrôler l’atmosphère du four lors de la cuisson, justement pour contrôler le degré d’oxydation de l’élément utilisé dans le décor. La cuisson de pièces céramiques peut se faire en oxydation ou en réduction. On se place toujours du point de vue de la céramique, c’est-à-dire que l’atmosphère est oxydante ou réductrice pour la céramique. Cela dépend de la présence ou non d’oxygène dans l’atmosphère du four. L’oxygène appartient au couple O₂/H₂O (rappelons qu’on note Ox/Red, donc l’oxygène O₂ est l’oxydant, et l’eau H₂O est le réducteur). L’oxygène va donc réagir avec le réducteur d’un autre couple, et la réaction va consister à réduire l’oxygène (puisqu’il est l’oxydant, on dit qu’il va être réduit). Le type de cuisson dépend d’où provient l’oxygène : de l’atmosphère du four ou de la céramique ?
Atmosphère oxydante
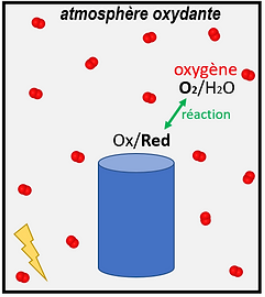
La cuisson en atmosphère oxydante ou en oxydation se fait généralement dans un four électrique, où l’atmosphère contient de l’oxygène.
L’atmosphère contient de l’oxygène donc le réducteur participant à la réaction va être dans la céramique (dans son décor). On dit donc « en atmosphère oxydante » car l’atmosphère, chargée en oxygène oxydant, va réagir avec le réducteur dans la céramique, qui va être oxydé (le réducteur est oxydé).
Atmosphère réductrice
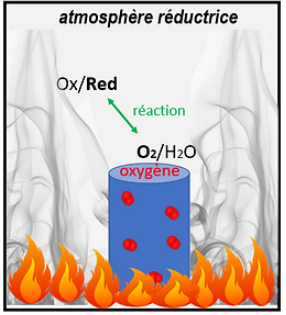
> La cuisson en atmosphère réductrice ou en réduction se fait généralement dans un four à combustible, où l’atmosphère est privée d’oxygène. Pour cela, on ferme les ventaux d’aération du four: il se remplit de fumée. Les oxydes métalliques (qui par définition contiennent de l’oxygène) et/ou la couverte vont alors libérer de l’oxygène dans l’atmosphère du four, dans laquelle cet élément fait défaut.
On dit donc « en atmosphère réductrice » car l’oxygène oxydant est contenu dans la céramique donc il va être réduit, par réaction redox avec un réducteur de l’atmosphère du four.
Remarque importante : En réalité, ce n’est pas l’ensemble de la cuisson qui a lieu en oxydation ou en réduction. Des phases d’oxydation et de réduction se succèdent au long de la cuisson, et on essaie parfois de les contrôler pour avoir la couleur souhaitée.
Sources :
– connaissances personnelles
– cet article assez détaillé
– la fin de cet article (sur la cuisson)
>> Je ne pense pas que l’explication chimique de ces processus puisse être demandée dans les épreuves PSE, EP1 ou EP2. J’ai vérifié le programme de physique-chimie pour ceux qui ne sont pas dispensés de cette épreuve, et l’oxydo-réduction n’y apparait pas. CEPENDANT, il me parait intéressant d’avoir bien compris les bases chimiques, pour exploiter au mieux les propriétés de la matière d’œuvre. <<
~ Mise en garde sur la toxicité de la matière d’œuvre ~
Il faut bien avoir conscience de la dangerosité et toxicité de la matière d’œuvre (oxydes, colorants, engobes, émaux) pour l’homme ET pour l’environnement. Quelques recommandations importantes :
– Toujours lire attentivement les FDS (Fiches de sécurité) des produits avant de les acheter (cf. mon article à ce sujet)
– Éviter de boire ou manger dans son atelier, ou le faire à l’écart, pour éviter d’ingérer par inadvertance un produit chimique
– En cas d’ingestion d’un produit chimique (oxyde, émail, engobe), appeler le centre antipoison avant de faire quoi que ce soit d’autre. Ne rien manger ou boire avant d’avoir connaissance de leurs recommandations.
– Éviter de jeter des produits chimiques à l’évier, car ils finissent dans les rivières si les stations d’épuration ne peuvent pas les filtrer.
La grande majorité des oxydes étant toxiques, on leur réservera un usage non-alimentaire. En effet, recouvrir une couche d’oxyde par une glaçure modifie la composition chimique de celle-ci, et en particulier certains oxydes abaissent le point de fusion de la glaçure. Après cuisson, le risque est que l’émail soit sous-cuit. Certains oxydes (cuivre, dioxyde de manganèse) facilitent la lixiviation* de la glaçure. Seul un test en laboratoire permet de vérifier la quantité de décor qui passe en solution. Lire la FDS du produit permet néanmoins de se renseigner (présence ou absence de plomb, de cadmium…) .
Pour connaître la toxicité de chacun des éléments dont on va parler, se référer à cet article de Officiel Prévention, qui présente cela de manière très détaillée.
~ Les oxydes métalliques ~
Généralités
Les oxydes* métalliques (voir début d’article pour la définition chimique) se composent d’anions (de l’élément oxygène, O²-) et de cations d’un élément métallique (fer, cuivre, cobalt, manganèse …) qui appartient souvent à la 4e période du tableau périodique. On peut les utiliser en jus d’oxydes, incorporés dans un engobe ou dans un émail, voire dans la pâte elle-même.
Élaborer une recette pour atteindre une couleur spécifique est plus compliqué que cela en a l’air, car la couleur dépend de nombreux paramètres : atmosphère de cuisson (oxydation/réduction), température, position dans le four, pourcentage d’oxyde utilisé, type et couleur naturelle de la terre … La couleur désirée sera sûrement obtenue à l’issue de nombreux tests.
Ma carte mentale
La meilleure façon de présenter les oxydes est la CARTE MENTALE. C’est pourquoi je vous invite à consulter celle que j’ai créée en cliquant ici. Vous verrez les couleurs que donnent les oxydes, et ceux à utiliser pour avoir chaque couleur. Dans la partie « par élément », vous aurez aussi accès à quelques informations concernant la toxicité.
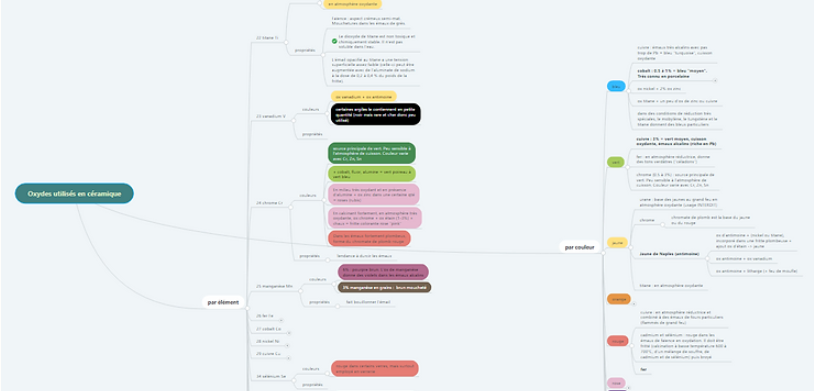
NB : Pour simplifier, je note « ox » pour « oxyde », sans préciser la formule chimique. Le terme oxyde est utilisé pour tous les types d’oxyde (dioxyde …)
S’il ne fallait retenir que le minimum :
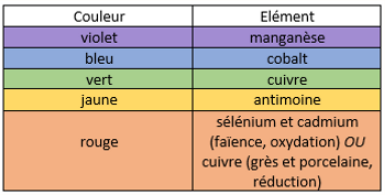
>> Une bonne partie du QUIZZ (cliquer sur le lien, ou en fin d’article) concerne les oxydes métalliques.
Sources
– Smart.Conseil : article de référence, très détaillé
– Ce très bon livre, scientifique et précis (Institut de Céramique Française)
– Pour les généralités, aude-lauvergnas-ceramique.fr
– Emaux et glaçures céramiques (livre sur Google Books), aussi très scientifique, avec des données chiffrées
– ceraformation.fr, donne une multitude d’informations chacun des oxydes
– Très belle revue de l’ESPCI (École supérieure de physique et de chimie industrielles de la ville de Paris), datant de 1901, mais extrêmement précieuse car très détaillée et permet de découvrir l’existence de recettes à décortiquer ailleurs ensuite !
– Et de très nombreux autres sites, pour vérifier la concordance des informations et croiser les sources. En faisant cet article, je me suis vraiment rendue compte à quel point il y a matière à apprendre sur les oxydes ! Si vous avez une mémoire visuelle, la carte mentale me semble vraiment être une ressource intéressante.
~ Les colorants composés ~
Les oxydes colorants, purs ou simplement mélangés entre eux, ne permettent pas d’obtenir toutes les teintes désirées. C’est pourquoi on fabrique des colorants composés en faisant réagir entre eux, souvent sous l’action de la chaleur, des oxydes métalliques.
Le frittage à haute température consiste à chauffer et mettre sous pression une poudre, sans que le composé principal n’atteigne son point de fusion. Elle se transforme alors en grains, qu’on peut ensuite broyer. La fritte est insoluble.
~ Les engobes ~

L’engobe (nom masculin) est un revêtement à base d’argile colorée ou non, mélangée à de l’eau (barbotine), pour modifier la couleur naturelle d’une argile poreuse. On peut y mélanger des oxydes pour avoir un engobe coloré.
Après sa pose, l’engobe peut être grattée avec une pointe, pour laisser apercevoir la couleur naturelle de la terre : c’est la technique du sgraffite. On peut aussi faire l’inverse : inciser la terre puis remplir les creux d’engobe : c’est la technique du mishima.
Buts
– L’engobe permet, non seulement de décorer, mais aussi de donner un aspect lisse à la pièce. C’est aussi une protection supplémentaire pour la surface de l’objet.
– On doit aussi appliquer un engobe spécial sur les plaques réfractaires du four. Cela les protège contre les coulures d’émail. C’est un mélange à partir d’alumine et de kaolin, à parts égales.
Qualités (de masques, de décoration)
– L’engobe peut servir à masquer la couleur naturelle de la terre. On peut ainsi travailler une terre rouge puis la recouvrir d’engobe blanche, par exemple pour faire le fond d’un autre décor.
– Elle peut aussi servir à décorer des œuvres en dessinant sur elles des motifs colorés, grâce à différents engobes.
Accord avec le support
– Le décor se fait le plus souvent lorsque la terre est à consistance du cuir (on dit aussi sur « terre verte ») : si la terre est déjà trop sèche, l’engobe risque de se décoller pendant la cuisson. Il faut appliquer l’engobe sur un support dépoussiéré, en couche fine, éventuellement en faisant plusieurs couches.
– Par ailleurs, il est capital que les coefficients de dilatation de la pâte céramique et de l’engobe concordent. Seule l’expérience permet de le vérifier : on peut observer une bonne adhésion, un écaillage, un décollement de l’engobe, ou d’autres défauts, comme l’apparition de bulles ou des fissures.
~ Les pâtes : blanches et colorées ~
Cet article concerne le décor plus que les caractéristiques physiques des pâtes. J’ai écrit un article consacré aux les caractéristiques physiques des pâtes (porosité, translucidité, principaux constituants, …).
Il y a principalement deux types de pâtes céramiques : les pâtes poreuses (terre cuite, faïence) et les pâtes vitrifiées (grès, porcelaine). La couleur de ces pâtes dépend de leur composition. Par exemple, la faïence rouge comporte naturellement de l’oxyde de fer, ce qui lui confère sa couleur (EP1A 2002).
On peut utiliser ces pâtes pour leur couleur, par exemple avec la technique du nériage (dans laquelle on maitrise le dessin qu’on va former, ou des terres mêlées, dans laquelle les terres se mélangent de manière aléatoire). Vous verrez dans cet article que la technique des terres mêlées doit vous faire penser à la ville d’Apt.
~ Les métaux précieux ~
On appelle métaux précieux l’or, l’argent et le platine.

Ce sont des décors de 3ème feu, ou de moufle ou de petit feu. En effet l’or s’applique sur émail cuit, en filet, en aplats ou en relief, sous forme de décors. On mélange les métaux précieux avec d’autres composés pour faire une solution liquide permettant l’application au pinceau.
Cet article explique comment l’or est déposé sur les pièces de la Manufacture de Sèvres, à l’atelier filage et dorure. Après passage en étuve à 100°C et cuisson entre 650 et 880°C, l’or a un aspect mat, et la pièce doit donc passer à l’atelier de brunissage. Cela consiste à frotter l’or avec un métal semi-précieux (agate, hématites) pour l’écraser et lui redonner tout son éclat. La technique du brunissage à effet consiste à tracer des motifs sur l’or avec une pointe d’agate.
~ Les lustres ~
Définition
Les lustres sont des solutions de combinaisons métalliques permettant d’obtenir des décors très brillants avec des effets irisés sur des supports lisses, comme l’émail. C’est pour cela que c’est un « décor de 3ème feu ». On applique le lustre sur une céramique cuite et émaillée, puis on la cuit une troisième fois à basse température (entre 650 et 800° selon le type de terre) et en atmosphère réductrice* (appauvrie en oxygène). Ensuite, on la lave, et on voit apparaitre le décor lustré, qui est imperceptible au toucher. La céramique lustrée présente un aspect brillant, avec des nanoparticules métalliques en suspension dans l’émail, dans lequel le lustre s’est fondu.
Les pigments sont soit des métaux précieux, soit des oxydes de certains métaux ; tandis que les solvants sont principalement des huiles essentielles.

Caractéristiques
Les couleurs obtenues varient en fonction du métal utilisé, de la recette du lustre, de la cuisson (température, atmosphère…) : elles vont du brun cuivré au jaune d’or, tirant parfois sur le vert. On peut même obtenir du rouge rubis.
Il existe deux types de décors lustrés : les lustres polychromes et les lustres monochromes.
C’est un décor typiquement islamique, appliqué à la céramique au IXème siècle (vers 820-860). On le trouve principalement sur de la vaisselle de luxe et des décors muraux (carreaux de mosquées notamment).
Sources :
– Encyclopædia Universalis : définition générale
– qantara-med.org (édité par l’Institut du monde arabe) : vidéo passionnante de 10min sur l’histoire de la céramique lustrée, complétée par un texte
– vev-porcelaine.com : étude sur les effets dorés en céramique (lustres et ors)
>> Mes recherches sur les lustres ouvrent sur l’histoire de l’art. <<
Lorsque je ferai des articles pour apprendre à reconnaître des céramiques, avec leur époque, le lieu de fabrication et la technique utilisée, j’en ferai probablement au moins un sur les céramiques islamiques.
{ En attendant, voilà un article sur les vases de l’Alhambra, que je trouve magnifiques ! }
Vous voulez vérifier vos connaissances ? Voilà un QUIZZ (Google Form) spécialement conçu pour cela ! Vous aurez accès aux réponses après avoir répondu à au moins une question. Ce quizz est très inspiré d’annales, il est donc utile pour faire le point !
> En faisant mes recherches, je suis tombée sur le logiciel Potoulz, qui est un logiciel de calcul céramique, utile pour fabriquer de nouvelles recettes. Je l’ai téléchargé mais jamais testé. Il y a des didacticiels qui me semblent très bien faits !
Découvrez d’autres articles !
- Protégé : Noël : une rencontre entre la terre et le sacréCe contenu est protégé par un mot de passe.
- Quel logo pour signer avec ton tampon personnalisé ?Si les potiers ont le réflexe de regarder le dos de leur assiette au restaurant, ce n’est pas un hasard ! En poterie, la signature permet de reconnaître en un coup d’œil la marque de l’artiste. Signer ses pièces porte… Lire la suite : Quel logo pour signer avec ton tampon personnalisé ?
- Bernard Palissy, figure de résilienceL’histoire de la céramique est jalonnée de quelques grands noms de céramistes et de styles. Plus l’époque est éloignée de nous, moins on a retenu les noms des céramistes. Cependant, l’un d’eux a marqué l’Histoire : Bernard Palissy, figure de… Lire la suite : Bernard Palissy, figure de résilience



Laisser un commentaire